TERMODINÁMICA

Caloría: Cantidad de calor necesario para elevar la temperatura de 1 gramo de masa de agua en 1 grado Celsius, desde 14,5 °C hasta 15,5 °C. «caloría-gramo» o «caloría pequeña»
Una variante empleada en el estudio de la nutrición, era sustituir la cantidad de agua referida por 1 kg; esta era la primera fuente de ambigüedad. «caloría-kilogramo», «kilocaloría», «caloría grande»
La segunda fuente de ambigüedad fue que la capacidad térmica específica del agua no es constante, sino que depende de la temperatura y la composición isotópica, lo que se arregló fijando la temperatura a que se había de medir, como se mostró en la definición inicial.
**************************************************************************************
El concepto de calorías en nutrición viola la segunda ley de la termodinámica
La nutrición arrastra desde hace décadas uno de los mitos más perversos y de mayor daño en la salud de las personas: “una caloría es una caloría”, esto implica básicamente que lo más importante de cualquier estrategia nutricional son las calorías y que la fuente de dichas calorías no importa, por lo tanto 2000 Kcal de brócoli, pechuga de pollo o caramelos son lo mismo.
Si bien, espero, ningún profesional de la salud en su sano juicio diría que esto es así, a la hora de analizar las estrategias empleadas para mejorar la composición corporal, principalmente tratar de disminuir el tejido adiposo, no son pocos los que optan por esta opción.
Capacitación Recomendada
La realidad es que si uno tiene en cuenta la primera ley de la termodinámica (la energía no se crea ni se destruye, se conserva), las calorías, sea cual sea su precedencia, tienen la misma cantidad de energía potencial. Por definición 1 kcal. Es la cantidad de calor necesario para elevar la temperatura del agua (pura) 1˚C (desde 14,5 a 15,5 y a presión atmosférica) por lo tanto, esta energía potencial se puede traducir en calor o trabajo y se conservara en su magnitud. Sin embargo, cuando entra en juego la biología las cosas no son tan simples.
El cuerpo humano es un sistema altamente complejo, con un elaborada e intrincada regulación del balance energético. Diferentes nutrientes tienen un impacto totalmente diferente tanto hormonal como en las vías metabólicas, las cuales son más o menos eficientes en las reacciones que contienen lo cual conlleva una menor o mayor pérdida de energía en forma de calor. Es acá donde entra en escena la 2˚ Ley de la termodinámica.
La 2˚ ley, nos dice dos cosas, la primera es que en cualquier proceso irreversible, la ENTROPÍA (en la química se traduce como desorden, Ej.: proteínas = orden, Aminoácidos = desorden) tiene que aumentar, y es esta ley la que dirige las reacciones químicas y la razón de la espontaneidad de dichas reacciones (a modo de ejemplo ilustrativo, si uno tira una gota de sangre en un vaso de agua, la misma se dispersará y será imposible volver a concentrarla en un pequeño volumen, a menos que se gaste energía, esta tendencia al desorden es la entropía), en segundo lugar, en toda reacción química parte de la energía utilizada se disipará en calor en mayor o menor medida según su eficiencia (a mayor eficiencia, menor calor disipado). Por lo tanto, la primera ley nos dice que el total de energía atribuible a trabajo, calor y a la composición química será constante, lo que no nos dice es si esa reacción efectivamente ocurrirá, ni tampoco la distribución relativa de dichas formas de energía e implica que “algo se perdió y no puede ser recuperado” (energía o incluso información).
Sin embargo hay una pequeña “trampa” cualquier sistema biológico es un sistema abierto con lo cual la entropía interna y la externa serán inversamente proporcionales, para ejemplificarlo de mejor manera tomaremos la siguiente situación: cuando ingresa alimento, el cuerpo lo “desarma” por lo tanto la entropía aumenta, sin embargo en muchísimas ocasiones es necesario rearmarlo (síntesis de proteínas, almacenamiento de glucógeno, síntesis de ADN, etc.), obviamente en forma predecible, por lo tanto la entropía disminuirá. Lo que nos dice la segunda ley es que, si en un sistema la entropía decrece, en el ambiente (universo) se incrementará aún más, por lo que este incremento se debe a la radiación de calor por parte del cuerpo y por ende respeta una de las leyes más fundamentales de la física que nos dice que el universo tiende a aumentar su entropía.
La primera ley entonces nos dice cuanta energía se necesita para por ej. Sintetizar ADN sumada a la perdida de calor para satisfacer la segunda ley (sin tomar en cuenta que el desacoplamiento mitocondrial, por ej. genera calor sin generar trabajo (Non-Shivering Thermogenesis) (Ricquier y Bouillaud, 2000).
Para un mayor entendimiento del tema, los invito a leer sobre el “demonio de Maxwell” o “paradoja de Maxwell” lo cual podría ser una explicación a la aplicación biológica del concepto de entropía, el de sistema cerrado y abierto y el rol de las enzimas.
Por lo tanto, no hay forma que “una caloría sea una caloría” en un sistema biológico. Este sistema trata de mantener baja entropía (alta entropía interna = muerte) y por ende aumenta la del ambiente (universo) perdiendo energía.
Volviendo a la nutrición, en dietas cuyo objetivo es la pérdida de peso, la ineficiencia es deseada y esta altamente relacionada a las actividades enzimáticas y niveles hormonales, dicha ineficiencia es medida en el llamado “efecto térmico de los alimentos o “termogénesis inducida por la dieta”, esto es el calor generado al digerir la comida, absorberla y metabolizarla, en lo cual hay vasta literatura al respecto, incluyendo una excelente review de Jéquier (2002), donde concluye que este efecto térmico de los alimentos seria de 2-3% para los lípidos, 6-8% para los carbohidratos y 25-30% para las proteínas, lo que deja en claro que la eficiencia no es la misma y la entropía varia en su magnitud.
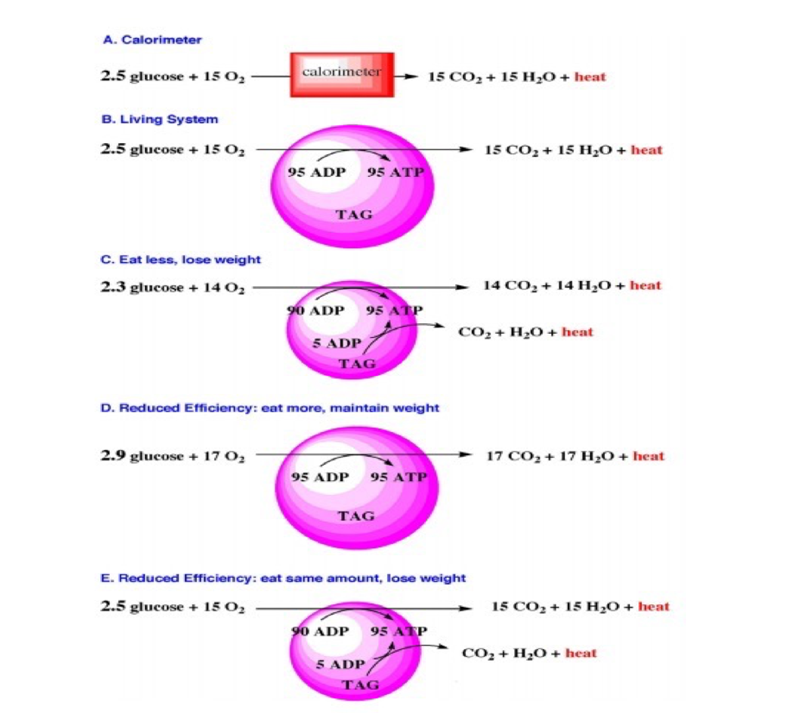
Fig.1:
A: la oxidación de glucosa en un calorímetro es 100% ineficiente. Los productos de la oxidación son CO2, H2O y el total de la energía liberada en forma de calor.
B: para ilustrar la primera ley de la termodinámica en sistemas biológicos, debemos considerar la que la conservación de la materia y energía implica excreción de productos al ambiente. Ni CO2 ni H2O permanecen en el organismo, solo el ATP, representando la energía útil, es retenido. El calor eliminado constituye el 60% de la energía de oxidación, mientras que la eficiencia es reflejada en el ATP retenido. Las reservas de grasas del cuerpo se muestran en forma de TAG (triacilglicerol).
C: la forma más común de pensar la reducción de peso es reduciendo la ingesta de calorías. Si el sujeto ingiere 2,3 moles de glucosa y produce solo 90 moles de ATP, la utilización de las reservas de TAG será necesaria para suplir el faltante de 5 ATP y mantener la homeostasis. CO2 y H2O (y Calor) serán excretados (e Irradiados) generando pérdida de peso.
D: si la eficiencia es reducida, entonces nuestro sujeto, deberá comer mas (ej.: 2,9 moles de glucosa) para producir 95 moles de ATP y mantener el peso. CO2 y H2O adicionales serán excretado manteniendo el peso constante.
E: ante una reducción de la eficiencia metabólica (de 40% a 38% en este ejemplo), 90 moles de ATP serán producidos por la oxidación de 2,4 moles de glucosa. Los faltantes 5 moles de ATP necesarios para mantener la homeostasis provendrán de la oxidación de las reservas de lípidos (también podría ser de tejido muscular según contexto). Como resultado se verá una disminución del peso. Extraído de Fine y Feinman, 2004
Termogénesis Adaptativa
Si partimos de la recomendación de “contar calorías”, esto implicaría adoptar una conducta de “comer menos, moverse más” para poder así establecer un déficit calórico o un balance calórico negativo. El problema con dicha premisa radica en su imposibilidad tanto práctica como biológica (Guth, 2014).
Incluso el más motivado e informado individuo es difícilmente capaz de estimar su ingesta de calorías (precisión en la ingesta, precisión en la información de las etiquetas y precisión en la real absorción de las mismas) (Baer y cols., 2010; Urban y cols., 2010; Hall y cols., 2012; Novotny y cols., 2012) y mucho menos su gasto, no solo en actividad física, sino también en el altamente variable gasto de procesos metabólicos y digestivos entre otros, (Feinmann y Fine, 2004; Westertrep y col., 1999; Novotny y col., 2014; Jakubowicz y cols., 2013) Incluso con el uso de tecnología disponible en el mercado (Lee y cols., 2014).
Por otro lado, biológicamente, la ingesta de calorías y el gasto energético están fuertemente regulados, por lo tanto, una fuerte reducción de calorías ingresadas resultara en una compensación proporcional en el gasto y vice – versa (Leibel y cols., 1995; Harris, 1990; Gibson y cols., 2005; Sumithran y Proietto, 2013; Ochner y cols., 2013; Lustig, 2006; Ludwig y Friedman, 2014). Por esta razón, cualquier persona que trate de consumir menos calorías resultará en una respuesta cerebral manifestada como cansancio (para disminuir el gasto) y en la gran mayoría de los casos, un hambre incontrolable y un impulso por alimentos calóricamente densos (Leibel y cols., 1995; Harris, 1990).
Sin embargo, algunas personas tienen éxito (mayormente temporal) al adoptar este tipo de estrategias lo cual nos ayuda a plantear algunas preguntas: ¿Por qué y Cómo se llega a un balance neto negativo de gasto energético? O ¿Cómo es posible perder masa magra y seguir aumentando tejido adiposo?, por tanto el concepto de calorías no explica la respuesta no linear a los desbalances calóricos en el tiempo (Shook y cols., 2014; Hall y cols., 2011 y 2013) como tampoco explica por qué y cómo se desarrollan anormalidades metabólicas (Shah y Braverman, 2012; Widman y cols., 2008) y procesos patológicos relacionados con la obesidad aún antes de que haya variaciones en el peso corporal (Coutinho y cols., 2013; Song y cols., 2007; Hamer y Stamatakis, 2012), o incluso porqué mejoras ocurren aún ante un mantenimiento estable del peso (Gannon y Nutall, 2006) o porqué algunas patologías metabólicas no siempre disminuyen con una disminución concurrente del peso corporal (Wing y Bolin, 2013)
Regulación Hormonal y Metabólica
El tejido adiposo es un tejido altamente complejo, el cual tiene un rol fundamental en el control del apetito, regulación del peso y gasto energético. Normalmente cuando los adipocitos se “llenan” (almacén de lípidos) liberan una hormona llamada Leptina, la cual, nuevamente, en condiciones normales, se une a sus receptores en el sistema nervioso central, específicamente en el núcleo supraquiasmático en el hipotálamo (casualmente donde se encuentra el reloj biológico, más adelante veremos porque es importante) (Harfmann y cols., 2014; Margetic y cols., 2002) donde estimula distintos tejidos periféricos (glándula tiroides, tejido muscular, intestino, etc.) básicamente inhibiendo la ingesta y aumentando el gasto (Sumieran y Proieto, 2013; Lustig; 2006; Speakman y cols., 2011), también tiene varias funciones incluyendo fertilidad, inmunidad, función cerebral, etc. (Allison y Myers, 2014).
Ser resistente a la acción de dicha hormona es uno de los factores que lleva al aumento de peso, principalmente a expensas del tejido adiposo, lo cual tiene lógica, si “llenar” los adipocitos aumenta los niveles de leptina circulante, es el mecanismo compensatorio ideal ante la imposibilidad de la misma a estimular sus receptores y por ende cumplir su función. Lo cual genera un círculo vicioso difícil de romper (Friedman y Halaas, 1998; Allison y Myers, 2014; Dalamaga y cols., 2013; Schwartz y cols., 2000).
Los obesos tienen altos niveles de leptina, lo cual, en cualquier situación normal actuaría en sus receptores de tal manera que señalizaría para regular el apetito y el gasto energético. Sin embargo, los altos niveles de leptina no aseguran su correcta unión a sus receptores hipotalámicos, condición que se conoce como “resistencia a la leptina” (Considine y cols., 1996; Myers y cols., 2012; Jung y Kim, 2013). Por ende dicho problema de señalización se traduce en cambios fisiológicos y de comportamiento impulsados por el Cerebro para volver a llenar los depósitos de grasa que cree haber “perdido”, de tal manera que:
– Aumentará el apetito (para no morir de inanición en la que “cree” que está, condición que genera la mala señalización)
– Disminuir el gasto energético (el cerebro conserva la energía que cree que le falta, haciendo que se reduzca el nivel de actividad y se gaste menos incluso en reposo).
Teniendo en cuenta dicho mecanismo podemos concluir que al obeso no es consecuencia de la vagancia y glotonería (se mueve poco y come mucho) sino justamente lo contrario.
Otro punto importante es relacionar este mecanismo a la dificultad de sostener dietas bajas en calorías en el largo plazo lo cual no es la regla sino la excepción y una posible explicación es el rol de la leptina (Hinkle y cols., 2013; Wing y cols., 1996). Cuando la leptina cae, el hambre aumenta, disminuye la motivación a moverse y la energía gastada en reposo (Ahima, 2008; Keim y cols., 1998).
Por otro lado, la leptina y la insulina están estrechamente relacionadas y la resistencia a la leptina es el paso previo que genera la resistencia a la insulina y la diabetes tipo 2 (German y cols., 2010; Seufert, 2004).
Volviendo al punto en cuestión de las calorías, varios trabajos han demostrado como el consumo de fructosa a diferencia de la glucosa (ambos son isocalóricos = mismas densidad energética), tiene un impacto diferente tanto en la insulina como en la leptina circulante. Siendo que la fructosa es metabolizada principalmente por el hígado ya que es el único tejido que posee el transportador de membrana GLUT 5, el cual no necesita de insulina (sin insulina elevada, se evita el llenado del adipocito y por ende liberación de leptina), y a su vez tiene una alta tasa de extracción de la misma, se podría decir que virtualmente toda la fructosa consumida terminará en el hígado. Una vez en hígado, en caso de que las reservas de glucógeno hepático estén repletadas (o el sujeto en estado de inanición), la fructosa será convertida indirectamente en glucógeno (lo que hace una excelente opción en caso de necesitar repletar dichas reservas por ej.: deportista de alto rendimiento) (Douard, 2008; Kim y cols., 1988). En caso contrario la fructosa seguirá la vía glucolítica resultando en un exceso de acetyl-CoA en la mitocondria el cual producirá un exceso de citrato en el ciclo de Krebs que terminará saliendo al citoplasma del hepatocito y aportando a la de Novo lipogénesis (formación de triglicéridos, VLDL y Ácidos grasos libres), lo cual es uno de los elementos clave en la resistencia a la leptina (Banks y cols., 2004) y a la insulina con lo cual dos moléculas con las mismas calorías tienen un impacto metabólico totalmente diferente que pueden hacer una tremenda diferencia en el resultado final.
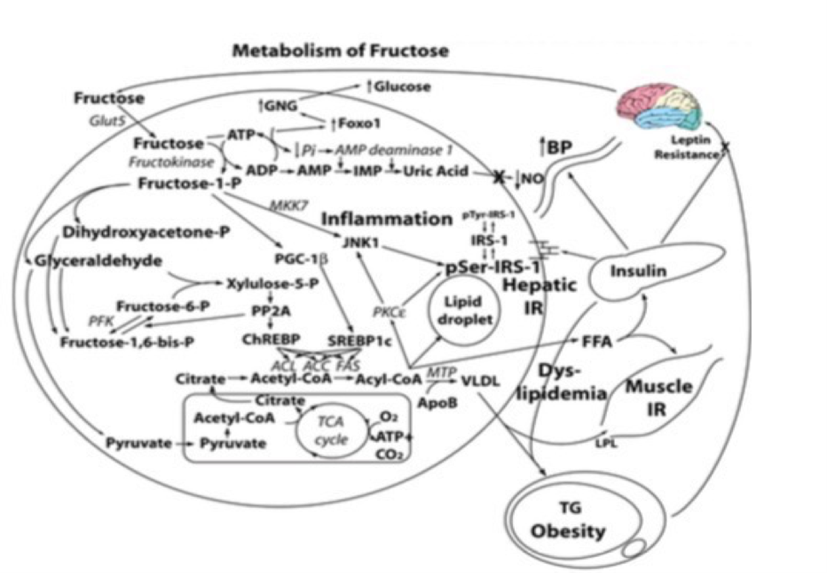
Fig. 2:
Metabolismo hepático de la fructosa. Ante una ingesta de sacarosa (50% glucosa + 50% fructosa), 20% de la glucosa y 100% de la fructosa es metabolizada en el hígado. La Fructosa induce los siguientes procesos : depleción de fosfato sustrato-dependiente, lo cual incrementa los niveles de ácido úrico y contribuye a la hipertensión arterial por inhibición de la síntesis endotelial de óxido nítrico, de Novo lipogénesis y dislipidemia, esteatosis e hígado graso, resistencia a la insulina en tejido muscular y hepático, incremento de la activación de FoxO1 lo que promueve gluconeogénesis y por ende hiperglucemia, hiperinsulinemia en el sistema nervioso central lo cual genera resistencia a la leptina y una aumento en la ingesta.
Si bien los mecanismos que generan resistencia a la leptina son varios, el principal factor asociado es la inflamación y la desregulación del ciclo circadiano, ambos procesos íntimamente relacionados a la salud mitocondrial, (verdadero sensor del estado energético celular y del medio ambiente) (Langmesser y Albretch, 2006; Peek y cols., 2013; Rey y Reddy, 2013; de Git y Adan, 2015; Figueiro y cols., 2012) lo cual no sólo tiene consecuencias en la sensibilidad a la leptina sino en varios procesos metabólicos (por no decir todos).
Un claro ejemplo es el trabajo de Arble y cols. (2015) donde uno de los receptores de la leptina fue genéticamente “borrado” en un grupo de ratones lo cual desencadenó todos los signos de la resistencia a la leptina incluyendo obesidad, sin embargo esto ocurría solo cuando los ratones eran expuestos a un ciclo luz/oscuridad normal de 12hs. (se veía una exacerbada hiperglucemia en ayuno, signo de resistencia a la insulina), cuando los mismos ratones genéticamente modificados eran expuestos a 24 hs. de luz, se regulaba la hiperglucemia lo cual muestra cómo la frecuencia de onda de la luz tiene un impacto metabólico marcado, cabe estacar que los ratones son noctámbulos (se alimentan de noche) a diferencia de otros mamíferos (como los humanos), con lo cual habría que ser cauteloso con las implicancias de dicho trabajo y sus posibles aplicación en humanos. Sin embargo, no son pocos los trabajos que relacionan los procesos metabólicos con el ciclo circadiano y la exposición a distintos ciclos de luz/oscuridad. (Mendoza, 2007; Yamaguchi y cols., 2013; Froy, 2010 y 2012; Johnston, 2014; Zhang y cols., 2012; Solt y cols., 2012; Shi y cols., 2013; Hartmann y cols., 2014; Oosterman y cols., 2015; Bass y Takahashi, 2010; Oishi y Katsutaka, 2013; Fonken y Nelson, 2014; Green y cols., 2008; Eckel-Mahan y Sassone-Corsi, 2013; Bellet y cols., 2010 y 2012). Los cuales muestran cómo la regulación del peso y la composición corporal trasciende las fronteras simplistas de las calorías y las mismas calorías suministradas con un “timing” o “contexto” determinado tendrán un impacto totalmente diferente.
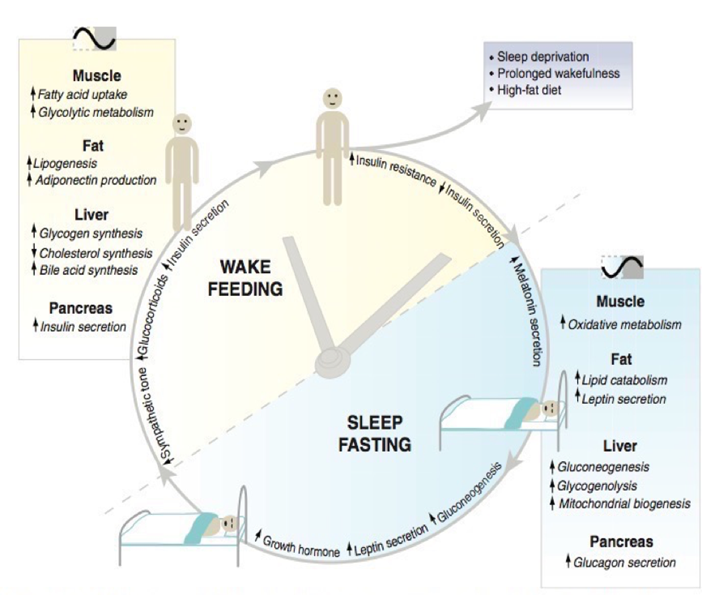
Fig. 3:
El comportamiento del Reloj biológico y los procesos metabólicos según momento del día. El “reloj” coordina apropiadamente los procesos metabólicos en los tejidos periféricos según el ciclo de luz/oscuridad. Por ejemplo: el reloj periférico hepático promueve la gluconeogénesis y glucogenólisis durante el periodo de sueño/ayuno, mientras que en periodo despierto/saciedad promueve la síntesis de glucógeno y colesterol. Un adecuado funcionamiento de los “relojes” periféricos mantiene los procesos metabólicos en sincronicidad con el medio ambiente, lo que es crítico para la salud de cualquier organismo. Los diferentes tejidos muestran diferentes “relojes” que controlan diferentes funciones los cuales dependen del “reloj” central en el SNC. Extraído de Baas y Takahashi, 2012.
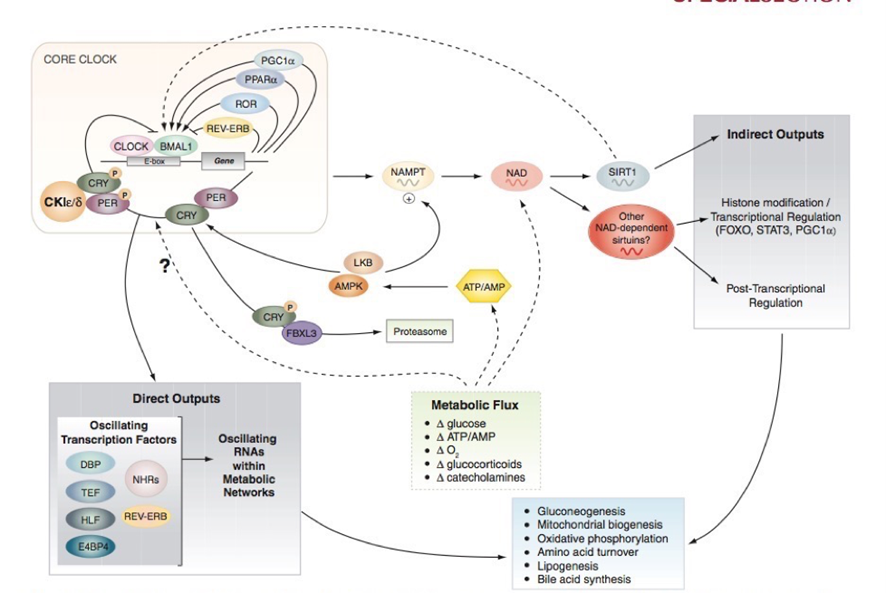
Fig. 4:
“Salidas directas e indirectas del “reloj” central. El reloj Central consiste en una serie de factores de transcripción/translación en “bucle” o loop que funcionan a modo de feedback los cuales sincronizan diversos procesos metabólicos directa e indirectamente, incluyendo gluconeogénesis y metabolismo oxidativo. A su vez este “reloj” recibe información reciproca de las cascadas metabólicas (SIRT1 y AMPK), lo cual funciona como regulador y genera que el ciclo circadiano y el flujo metabólico estén atados, especialmente en tejidos periféricos. Extraído de Bass y Takahashi, 2012.
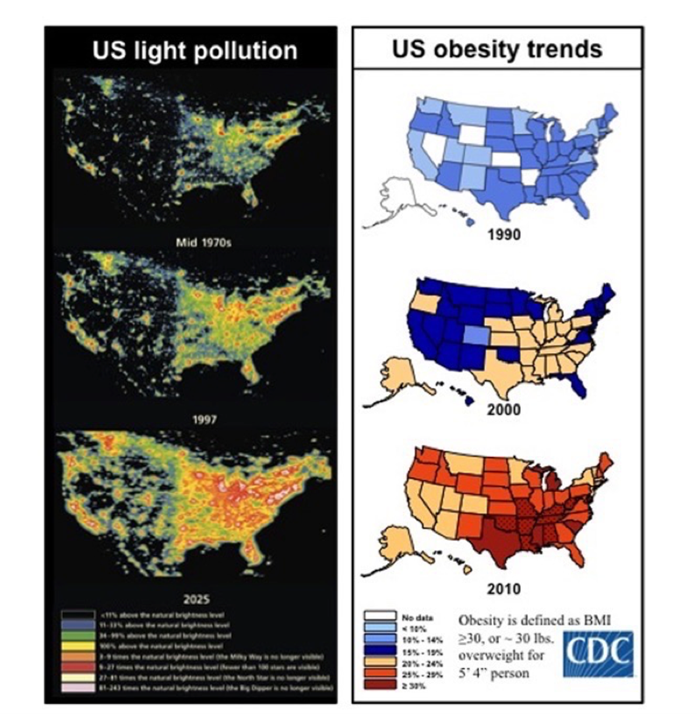
Fig. 5:
Exposición a la luz durante la noche y obesidad. En el panel izquierdo la tendencia de polución lumínica en EE. UU. desde 1970 hasta niveles proyectados para 2025. En el panel derecho, tendencias en obesidad en EE. UU. en 1990, 2000 y 2010. Extraído de Fonken y Nelson, 2013.
Por ultimo y no menos importante, a medida que uno revisa la literatura, se ve obligado a tomar diferentes posturas, sin embargo hay una frase que se presenta una y otra vez: CONTEXT MATTERS o traducido al español, lo que importa es el contexto, para ejemplificarlo me gustaría incluir algunos trabajos que llamaron mucho mi atención, los dos primero muestran como la elección de diferentes macronutrientes en un contexto determinado tiene impactos diferentes y otro que ejemplifica cómo el contexto manipula el impacto de los macronutrientes.
En un trabajo de José Antonio (2014) unos 30 individuos físicamente activos y sanos (esto quiere decir sin síndrome metabólico, CONTEXTO!!) y fueron asignados ya sea a un grupo control o a un grupo de consumo elevado de proteínas, y cuando digo elevado es elevado (una de las dificultades del estudio fue la adherencia a tal ingesta) (4,4 gr/kg/día) siendo 5,5 veces mayor a la ingesta diaria recomendada durante 8 semanas (la cual me parece insuficiente, incluso absurda), también fueron instruidos a mantener la misma cantidad de carbohidratos y grasas y los hábitos de entrenamiento (Nuevamente, CONTEXTO!!). Entonces para resumir, sólo aumentaron y mucho, su consumo de proteínas, por ende, las calorías aumentaron significativamente, por lo que si todas las calorías fueran lo mismo uno esperaría ver un aumento de peso.
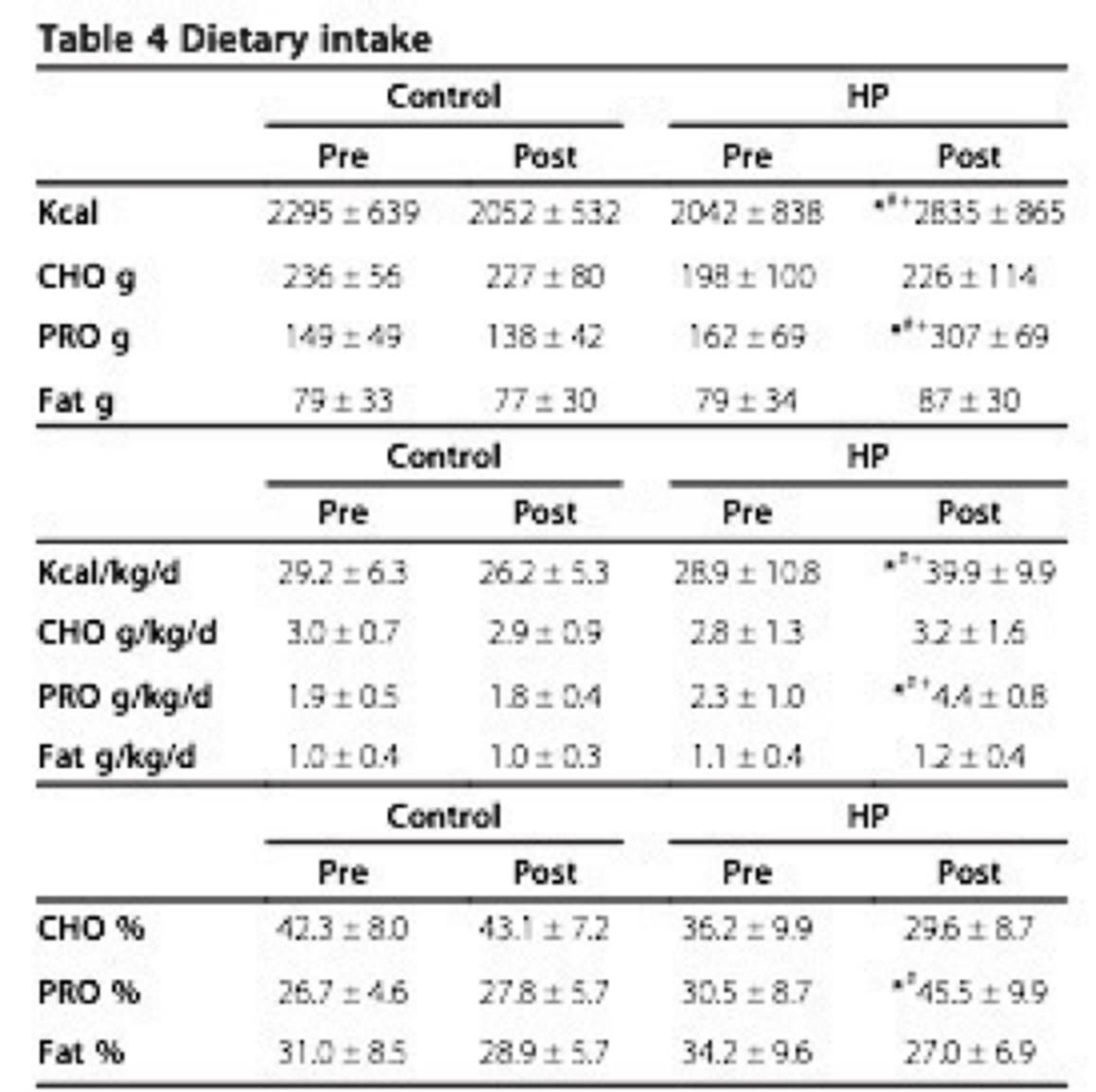
Fig.6:
Características tanto calóricas como de macronutrientes de los individuos del estudio. Extraído de Antonio, 2014.
Sin embargo, a continuación, se podrá ver la tabla de los resultados del dicho trabajo
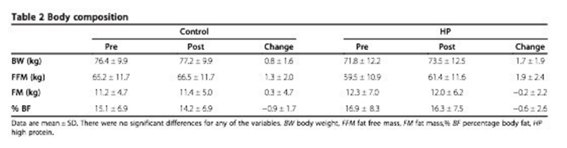
Fig.7:
Modificaciones en la composición corporal y el peso. Extraído de Antonio, 2014
Claramente se puede apreciar que si bien hubo un aumento en el peso corporal (1,7kg), este aumento no tiene relación con el exceso de calorías consumidas (+800/semana) y no solo eso, sino que, analizando la composición corporal, el aumento fue solo a expensas del tejido muscular (+1,9kg) ya que incluso se vio una reducción del tejido adiposo (-0,2kg).
El segundo estudio en cuestión fue llevado a cabo por un grupo de investigadores (Maslow y cols., 2014) en el cual compararon los efectos de dos intervenciones dietarias en pacientes obesos y diabéticos tipo 2 o con resistencia a la insulina. Se dividió a los integrantes del estudio en 2 grupos, uno con una dieta moderada en carbohidratos baja en calorías (MCCR) (45-50% CHO, 165 gramos por día, baja en grasas y con un déficit de calorías de 500/día) y otra muy baja en carbohidratos LCK (‹50 gramos de Cho por día sin restricción de calorías), ambos grupos debían mantener su ingesta de proteínas.
Resultados: ambos grupos cumplieron con los objetivos del estudio en cuanto a macronutrientes, aunque la disminución en calorías fue superior en ambos a pesar de que el grupo de LCK no tenía una restricción en las mismas, esta se produjo de manera espontánea.
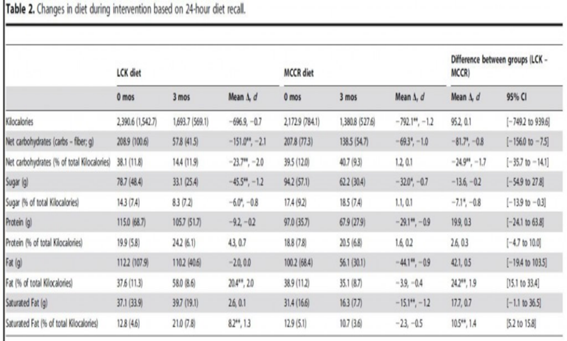
Fig.8:
Cambios en las características de la dieta en ambas intervenciones. Extraído de Maslow y cols., 2014.
En cuanto al peso corporal a pesar de consumir menos calorías, los pacientes asignados a MCCR perdieron menos peso que los asignados a LCK, la composición corporal no fue medida lo cual podría sugerir que la disminución de peso podría estar asociada a perdidas de masa muscular, sin embargo, el grupo LCK fue el que menos disminución en la ingesta de proteínas tuvo al tiempo que redujo menos las calorías con lo cual difícilmente sea el caso.
En cuanto a los parámetros metabólicos, proteína C reactiva (parámetro que marca inflamación) mejoró más marcadamente en la dieta LCK como así también niveles de insulinemia y glucemia en ayuno.
Por último, el punto más relevante a mi juicio de este trabajo:
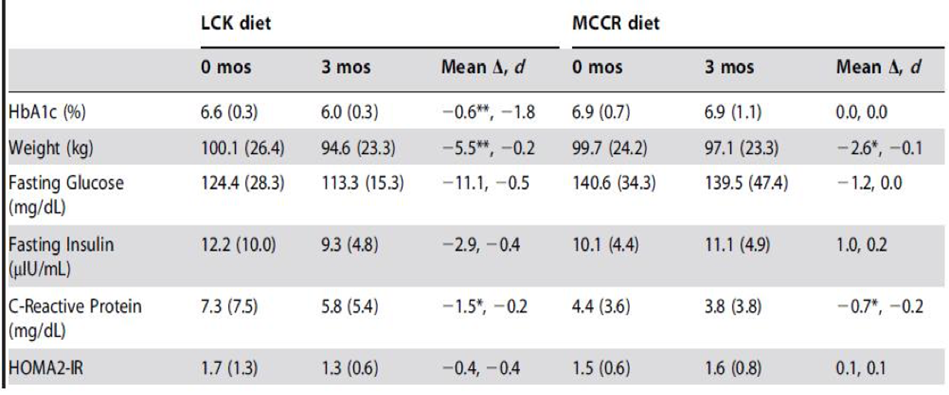
Fig.9:
Cambios en las variables metabólicas analizadas en ambos grupos. Extraído de Maslow y cols., 2014.
Como anteriormente comenté el contexto es una de las claves, un reciente trabajo de Nedeltcheva y cols. (2010) investigó el impacto de diferentes regímenes de sueño y por ende diferentes ciclos de luz/oscuridad sobre la composición corporal y el metabolismo.
10 sujetos con sobrepeso fueron expuestos a 14 días de restricción calórica moderada y asignados tanto a 8,5 como a 5,5 horas de sueño.
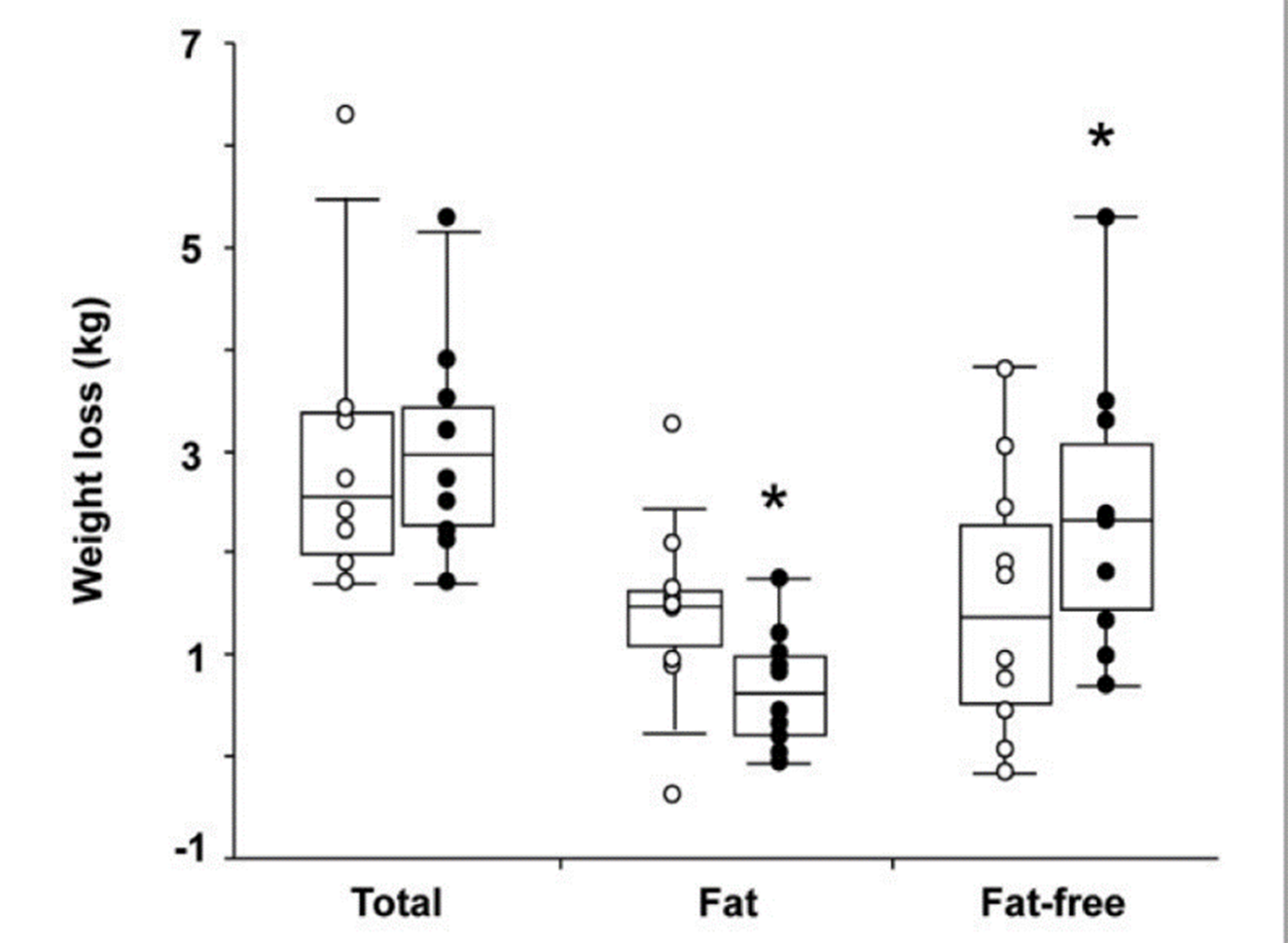
Fig.10:
Cambios en la composición corporal y peso en los grupos de 8,5hs (círculos claros) y de 5,5 hs. (Círculos oscuros). Extraído de Nedeltcheva y cols., 2010.
A modo de resumen, aquellos que durmieron 8,5hs. por noche perdieron la mitad de su peso en masa grasa y la mitad en masa muscular, en cambio los que fueron privados de horas de sueño, solo 1/5 del peso perdido fue tejido adiposo a pesar de mantener tanto macronutrientes como cantidad de calorías. En un contexto de ciclo luz/oscuridad y un ritmo circadiano normal la misma estrategia nutricional tiene un impacto muy diferente que en un contexto de ciclo circadiano alterado. Cabe destacar que ambas intervenciones tuvieron una disminución de tejido muscular inaceptable posiblemente debido a la baja ingesta de proteínas y de calorías que conlleva a un balance nitrogenado negativo.
Para pasarlo en limpio y mostrarlo en números hagamos el siguiente análisis. Ambos grupos consumían 1448 Kcal/día, controlado en el laboratorio, la comida pesada, etc., etc. El gasto energético se midió mediante el método de agua doblemente marcada (el Gold estándar en dicha medición con una tremenda precisión) lo cual daba en promedio para ambos grupos 2136 Kcal/día, lo que nos deja con un déficit de 688 Kcal/día. Sin embargo, el grupo que dormía 8,5 hs/día perdió 50% más calorías de las que debería (347) y el grupo con sueño restringido, 20% menos (134), lo que nos lleva a una diferencia de 481 Kcal. (no incluí la cuenta completa para no marear al lector) que “mágicamente” desaparecieron.
Como conclusión final a la hora de garantizar el éxito de una intervención nutricional, la biología no entiende de calorías, sino de información la cual integrará para su correcta regulación y funcionamiento expresada en una adecuada señalización que generará o no los resultados deseados. Partiendo de esta base las calorías son solo una parte de la información, solo una página de un libro mucho más grande con varios capítulos cuyo título es CONTEXTO.
Artículos, estudios y evidencias científicas
